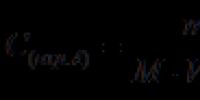Stanovenie ochratoxínu a metódou HPLC. Optimalizácia analytických metód na detekciu, identifikáciu a kvantifikáciu ochratoxínu a v potravinách
Koncentrácia ochratoxínu A vo vzorke, mg/kg
Limity relatívnych chýb (index presnosti) (±d), %, R = 0,95
Štandardná odchýlka opakovateľnosti (s r), %
Limit opakovateľnosti ( r), %
Úplnosť extrakcie látok, %
4. Meracie prístroje, pomocné zariadenia, sklo, činidlá a materiály
4.1. Meracie prístroje
4.2. Pomocné vybavenie
|
Zariadenie na pretrepávanie vzoriek typu АВУ-6С alebo podobné |
TU 64-1-2451 |
|
Rotačný odparovač IR-1M s odlučovačom alebo podobným |
TU 25-11917 |
|
Laboratórna sušiareň s chybou udržiavania teploty ±2,5 v rozsahu od 50 do 350 °C |
TU 16-531.639 |
|
Chladnička pre domácnosť |
|
|
Elektrický laboratórny mlyn EM-3A alebo podobný pH meter |
TU 46-22-236-79 |
|
Magnetické miešadlo typu MM 5 s miešadlom |
TU 25-11.834-80 |
|
Kužeľové banky s plochým dnom 250 cm 3 s NSh 29, typ KnKSh 250-29/32 |
GOST 10394-74 |
|
Tmavé sklenené skrutkovacie fľaše (nečisté), objem 7 cm 3 |
|
|
Odmerné banky, objem 100, 500, 1000 cm 3 typ 2-100-2,2-500-2 |
|
|
Laboratórium lievikov |
|
|
Banky hruškovitého tvaru, 10 cm 3 s NSh 14,5, typ GrKSH-10-14/23 |
GOST 10394-72 |
4.3. Činidlá a materiály
|
Monosubstituovaný fosforečnan sodný, 2-vodný, chda |
|
|
Chlorid sodný, chemicky čistý |
|
|
Acetonitril, vysoký stupeň čistoty 0 |
|
|
Metanol, osch |
|
|
Kyselina fosforečná, vysoká čistota |
TU 2612-014-00203677-97 |
|
Ľadová kyselina octová, chemicky čistá |
|
|
Toluén, chda |
|
|
Imunoafinitné kolóny Ochraprep (R-Biopharm, UK) |
. Príprava na meranie
5.1. Príprava štandardných roztokov ochratoxínu A
Na prípravu štandardného skladovacieho roztoku (koncentrácia ochratoxínu A je 10 ng / μl) sa 5 mg vzorka kryštalického ochratoxínu A vloží do 500 cm 3 odmernej banky, 50 cm 3 zmesi toluén-kyselina octová (98 :2 % obj.) sa naleje, opatrne sa mieša až do úplného rozpustenia látky a privedie sa rovnaká zmes rozpúšťadiel po značku. Na stanovenie presnej koncentrácie zásobného roztoku sa meria jeho optická hustota pri vlnovej dĺžke 333 nm (D 333). Koncentrácia roztoku sa vypočíta podľa vzorca:
Ďalej sa 5 cm 3 štandardného roztoku ochratoxínu A s koncentráciou 10 ng/μl zriedi zmesou toluén-kyselina octová (98 : 2 % obj.) na objem 100 cm 3, čím sa získa pracovný roztok s koncentráciou 0,5 ng/μl.
Na prípravu pracovných roztokov ochratoxínu A s koncentráciou 0,005; Odoberie sa 0,05 a 0,1 ng/ul, 50, 500 a 1000 ul roztoku s koncentráciou 0,5 ng/ul, odparí sa do sucha a rozpustí sa v 5 cm3 mobilnej fázy.
Skladovací roztok ochratoxínu A sa uchováva v sklenenej nádobe so zabrúsenou zátkou na tmavom chladnom mieste (pri teplote asi 0 °C) do jedného roka a používa sa na prípravu pracovných štandardných roztokov. Pracovné štandardné roztoky sa uchovávajú vo fľaštičkách z tmavého skla na tmavom a chladnom mieste (pri teplote asi 0 °C) počas 1 mesiaca.
Pred použitím pracovných štandardných roztokov ich treba zohriať na izbovú teplotu a až potom otvoriť zátky.
5.2. Príprava roztoku fosfátového pufra, pH = 7,4
Časť 12-vodnej disubstituovanej fosforečnanu sodného s hmotnosťou 1,15 g, časť monosubstituovanej 2-vody sodíka s hmotnosťou 0,124 g a časť chloridu sodného s hmotnosťou 1,74 g sa prenesie do odmernej banky s objemom 100 cm3, 10 - 20 pridá sa cm 3 destilovanej vody. Miešajte a doplňte objem roztoku v banke po značku. Čas použiteľnosti - 1 mesiac v chladničke.
5.3. Príprava zmesí rozpúšťadiel
toluén-octová kyselina (98:2 % o.).
Do 1000 cm 3 odmernej banky pridajte 20 cm 3 kyseliny octovej a za stáleho miešania doplňte po značku toluénom. Čas použiteľnosti - 1 mesiac na tmavom chladnom mieste.
acetonitril-voda (60:40 % o.).
Do odmernej banky s objemom 1000 cm 3 pridajte 600 cm 3 acetonitrilu a za stáleho miešania dolejte po značku vodou. Čas použiteľnosti - 1 mesiac na tmavom chladnom mieste.
acetonitril-voda (60:40 % o.; pH = 3 ,0 ).
Do odmernej banky s objemom 1000 cm 3 pridajte 600 cm 3 acetonitrilu a za stáleho miešania doplňte po značku dvakrát destilovanou vodou. Pridaním kyseliny fosforečnej sa pH zmesi upraví na hodnotu rovnajúcu sa 3,0. Čas použiteľnosti - 1 mesiac na tmavom chladnom mieste.
metanol-octová kyselina (98:2 % o.).
Do odmernej banky s objemom 1000 cm 3 pridajte 20 cm 3 kyseliny octovej a za stáleho miešania doplňte po značku metanolom. Čas použiteľnosti - 1 mesiac na tmavom chladnom mieste.
. Odber vzoriek a príprava vzoriek na analýzu
6.1. Výber vzorky
Aby sa zohľadnili špecifiká odberu vzoriek určitých typov výrobkov, mali by ste sa riadiť súčasnou regulačnou a technickou dokumentáciou:
„Kukurica. Pravidlá prijímania a metódy odberu vzoriek“ GOST 13586.3-83;
„Krúpa. Pravidlá prijímania a metódy odberu vzoriek“ GOST 26312.1-84;
„Múka a otruby. Metódy prijímania a odberu vzoriek“ GOST 27668-88;
„Potravinové výrobky v konzervách. Odber vzoriek a ich príprava na testovanie” GOST 8756.0-70.
Vzorky na analýzu, reprezentujúce koncentráciu mykotoxínov pre celú dávku, by sa mali odoberať z vopred homogenizovanej priemernej (počiatočnej) vzorky s hmotnosťou 2 kg.
6.2. Príprava vzorky na analýzu
Vybrané vzorky sa drvia 1 - 2 minúty v laboratórnom mlyne. V tomto prípade sa použijú dve paralelné vzorky.
6.2.1. Extrakcia
Časť 25 g rozdrvenej vzorky sa vloží do 250 cm kužeľovej banky s plochým dnom, pridá sa 100 cm3 zmesi acetonitril-voda (60:40 % obj.). Extrahujte na šejkri 30 minút. Výsledná zmes sa prefiltruje cez skladaný papierový filter s modrou páskou. Vyberte 10 cm 3 filtrátu a pridajte 90 ml fosfátového tlmivého roztoku, pH = 7,4.
6.2.2. Čistenie extraktu
100 ml výslednej zmesi sa nanesie na imunoafinitnú kolónu rýchlosťou 1 - 2 kvapky za sekundu, premyje sa 20 cm3 roztoku fosfátového tlmivého roztoku, pH = 7,4. Ochratoxín A sa eluuje 3 cm3 zmesi metanol-kyselina octová (98:2 % obj.).
. Vykonávanie meraní
7.1. Príprava skúšobnej vzorky
Eluát sa odparí do sucha. Suchý zvyšok sa rozpustí v 400 μl mobilnej fázy (roztok A).
7.2. Chromatografické podmienky
Podmienky HPLC: mobilná fáza - acetonitril-voda (60:40 % obj.; pH = 3,0); rýchlosť mobilnej fázy - 1,5 cm 3 /min.
Fluorimetrický detektor je nastavený na vlnovú dĺžku budiaceho žiarenia 333 nm, na emisnej linke je inštalovaný emisný filter so šírkou pásma 466 nm.
Na analýzu vzorky sa 50 μl testovanej vzorky (roztok A) vstrekne do injektora chromatografu pomocou mikrostriekačky. V prítomnosti píku, ktorý sa zhoduje s retenčným časom s ochratoxínom A, vypočítajte hmotnosť ochratoxínu A v teste pomocou kalibračnej krivky.
. Spracovanie výsledkov merania
8.1. Konštrukcia odstupňovanej závislosti
Na vytvorenie kalibračného grafu sa vykoná chromatografická analýza série pracovných roztokov štandardov. Pomocou mikrostriekačky sa do injektora vstrekne 50 µl štandardného pracovného roztoku s koncentráciou 0,005 ng/µl, čo zodpovedá 0,25 ng ochratoxínu A. To isté sa robí pre ostatné štandardné roztoky s koncentráciou 0,05 a 0,10 ng/ ul, čo zase zodpovedá 2,5 a 5,0 ng ochratoxínu A na injekciu. Za týchto podmienok je retenčný čas ochratoxínu A v rozmedzí 4 až 5 minút. Na základe získaných údajov sa zostaví kalibračný graf (závislosť plochy chromatografického píku od hmotnosti ochratoxínu A v nástreku).
8.2. Registrácia výsledkov
Výpočet koncentrácie ochratoxínu A vo vzorke sa vykonáva podľa vzorca:
![]()
C (ochrana A)- koncentrácia ochratoxínu A vo vzorke, mg/kg;
M- hmotnosť vzorky na analýzu, g (25,0);
Tje hmotnosť ochratoxínu A zodpovedajúca objemu roztoku A zavedeného do chromatografu, ng;
V 1 - objem roztoku na extrakciu, cm3 (100);
D - limit absolútnej chyby:
![]()
d - hranica relatívnej chyby techniky (index presnosti), % (tabuľka 1).
Ak je obsah ochratoxínu A vo vzorke nižší ako dolná hranica rozsahu stanovených koncentrácií, výsledok analýzy sa prezentuje ako:
* 0,0001 mg/kg - limit detekcie.
8.3. Kontrola prijateľnosti výsledkov paralelných stanovení
Prípustný rozdiel medzi paralelnými meraniami (R) sa určuje na základe limitu opakovateľnosti (r) (Stôl 1):
R = 0,01 (r, %) x , mg/kg
Ak nezrovnalosť medzi paralelnými definíciami nepresahuje prípustnú hodnotu:
![]()
potom sa ako výsledok analýzy berie aritmetický priemer.
Pri prekročení normyRmerania by sa mali opakovať s použitím záložných vzoriek.
. Kontrola kvality výsledkov meraní
Frekvencia kontroly chýb merania závisí od počtu pracovných meraní za kontrolované obdobie a je určená plánmi kontrol.
Kontrolné vzorky sú pracovné vzorky potravinárskych surovín a potravinárskych výrobkov. Odoberie sa vzorka a rozdelí sa na 2 rovnaké časti. Jeden z nich sa ponechá nezmenený a do druhého sa pridá také množstvo štandardného roztoku ochratoxínu A tak, aby jeho hmotnostný podiel vo vzorke vzrástol o 50 - 100 % oproti počiatočnej hodnote. Prísada sa musí zaviesť do vzorky pred začiatkom prípravy vzorky.
Obe vzorky sa analyzujú v prísnom súlade s predpisom metodiky a získajú sa výsledky analýzy pôvodnej vzorky ( C (neg. A)) a vzorky s prídavkom ( OD ¢ (neg. A)). Stanovenie sa vykonáva za rovnakých podmienok, a to: analýzu vykonáva jeden analytik s použitím jednej sady objemového náčinia, činidiel, roztokov atď.
Algoritmus na vykonanie kontroly prevádzkovej chyby aditívnou metódou spočíva v porovnaní výsledku kontrolného stanovenia, ktorý sa rovná rozdielu medzi výsledkom kontrolného merania vzorky s aditívom ( OD
¢
(okrová)), vzorky bez prísady ( C (ochrana A)) a hodnotu aditíva ( C ext (ram.A)) so štandardom prevádzkovej kontroly (K). Rozhodnutie o uspokojivej chybe sa urobí vtedy, keď je splnená nasledujúca podmienka (keď R a Teplota okolia od 15 do 25 °С. Relatívna vlhkosť vzduchu nie viac ako 80% pri 25 °С. Atmosférický tlak 730 - 760 mm Hg. Napájacie napätie: 210 - 220 V. Frekvencia striedavého prúdu: 45 - 50 Hz.
naleje sa jedno prekrytie a v strednej časti dve prekrytia s minimálnym krokom medzi nimi, ktoré označujú hranice prichádzajúcich a odchádzajúcich vetiev pásky. Krok medzi presahmi na prichádzajúcej vetve pásky sa určuje pomocou závislosti aritmetickej progresie a na zostupnej vetve - podľa závislosti geometrickej progresie. V tomto prípade je potrebné nastaviť prvý člen aritmetickej postupnosti a vziať do úvahy, že posledná medzera medzi obloženiami nadchádzajúcej vetvy pásky je prvým členom geometrickej postupnosti a rozdiel a menovateľ postupnosti sú určená z celkovej medzery medzi obloženiami každej vetvy pásky.
U bubnovej čeľusťovej brzdy sa vyrovnávanie merných zaťažení dosahuje tak, že do viacdielnej brzdovej čeľuste sú na jej vstupnej a výstupnej časti uložené radiálne pohyblivé obloženia, ktoré sú vzájomne prepojené vyvažovačom, t.j. využíva sa princíp obyčajných závaží. Toto technické riešenie je chránené autorským certifikátom na vynález.
Stabilizácia povrchových teplôt v trecích pároch vyššie uvedených brzdových zariadení je dosiahnutá termoelektrickým efektom pomocou termočlánkov pracujúcich v režimoch termoelektrickej chladničky a termoelektrického generátora vo výstelkách vstupnej a výstupnej vetvy pásky, as ako aj vo vstupných a výstupných častiach trecích obložení čeľuste v hlavných a prídavných servo brzdách, v závislosti od tepelného zaťaženia ich trecích uzlov. Zároveň sa poskytuje
prerozdelenie tepelnej energie medzi povrchy trecích jednotiek bŕzd, čo vedie k jej kvázi stabilizácii. Prevádzka termočlánkov vo vyššie uvedených režimoch je teoreticky podložená.
Racionálne riadenie prevádzkových režimov pásovej brzdy sa uvažuje za predpokladu, že úroveň tepelného zaťaženia povrchových vrstiev trecích obložení neprekročí prípustnú teplotu pre ich materiály. Na realizáciu riadenia brzdných režimov možno použiť kombinované chladenie (termoelektrické s tepelnou trubicou) brzdových trecích párov.
Aplikáciou tohto technického riešenia sa dosiahlo zvýšenie účinnosti páskovej brzdy navijaka U2-5-5.
Tým sú naznačené spôsoby riadenia dynamického a tepelného zaťaženia trecích jednotiek brzdových zariadení.
LITERATÚRA
1. Vyhlásenie Pat. 63418А (Ukrajina). Spôsob riadenia špecifických zaťažení na vstupnej a výstupnej vetve brzdového pásu pásovej brzdy / A.I. Volčenko, V.V. Dyachuk, N.A. Volchenko a ďalší - B.I. - 2004. - Číslo 1. - V ukrajinčine. lang.
2. A.s. 1682675 A1 ZSSR. Bubnová brzda / A.I. Volčenko, V.V. Moskalev, P.A. Skorokhod a ďalší - B. I. - 1991. -
3. Pat. 2221944 C1 Rusko. Chladiace systémy pre brzdový mechanizmus so servopohonom a spôsob jeho implementácie / A.I. Volčenko, A.A. Petrik, N.A. Volchenko a ďalší - B.I. - 2004. - č.2.
Katedra technickej mechaniky
Prijaté 22.11.04
STANOVENIE OCHRATOXÍNU A V HROZNOVÝCH VÍNACH
E.N. RIKUNOVÁ, T.I. GUGUCHKINA
Severokaukazský zonálny výskumný ústav záhradníctva a vinohradníctva
Medzi mykotoxínmi zaujímajú osobitné miesto okrové toxíny. Produkujú ich niektoré druhy mikroskopických húb rodov Penicillium, Aspergillus, najmä A. ochraceus, P. viridicatum. Tieto plesne sú všadeprítomné, väčšinou v teplých a vlhkých podmienkach, spôsobujúce hnilobu hrozna pri dlhotrvajúcich dažďoch. Ochratoxíny pôsobia celkovo toxicky, pôsobia na obličky, pečeň, znižujú produktivitu, majú embryotoxické, mutagénne a karcinogénne účinky.
Medzinárodná agentúra pre výskum rakoviny klasifikovala ochratoxín ako potenciálny karcinogén a klasifikovala ho do triedy nebezpečnosti 2B. Keď je jedlo kontaminované ochratoxínmi, človek ochorie na balkánsku endemickú nefropatiu.
Patu-lin sa predtým vyskytoval vo vinárskych produktoch a nedávno sa objavili informácie o obsahu ochratoxínu A. Kontaminuje obilie, zeleninu, ovocie a výrobky z nich, krmivo, slad, pivo, džúsy a víno.
Vyvinuli sme metódu stanovenia ochratoxínu v hroznovom víne pomocou chromatografie na tenkej vrstve (TLC).
Tenkovrstvová chromatografia je typ kvapalinovej chromatografie vo vrstve sorbentu, ktorá je na jednej strane plochá a je uložená na plochom pevnom substráte. Hlavné znaky TLC sú spôsobené pohybom eluentu (rozpúšťadla) cez vrstvu sorbentu v dôsledku kapilárnych síl, čo zjednodušuje a uľahčuje chromatografický proces. Použitie univerzálneho sorbentu - silikagélu a otvorenej vrstvy poskytuje ľahkú aplikáciu vzorky, možnosť simultánnej analýzy viacerých vzoriek a jednoduchosť monitorovania elučného procesu.
Chromatografia na tenkej vrstve zahŕňa čistenie a koncentráciu mykotoxínov. Na tento účel sa používa dvojrozmerná alebo kroková chromatografia.
fiu. Prvým stupňom elúcie je čistenie, separácia rušivých látok, druhým stupňom je separácia mykotoxínov.
Analýza vzorky vína pomocou TLC zahŕňa fázy prípravy vzorky, platne, chromatografickej komory a eluentov, ako aj koncentračnej kazety Diapak C16MT; potom samotná chromatografia, odparenie eluentu z platne, identifikácia, kvantifikácia a dokumentácia.
Výhodou metódy je nielen jej jednoduchosť, dostupnosť, možnosť použitia špecifických vyvolávacích činidiel, potvrdzujúcich príslušnosť látky k požadovaným, nižšie nároky na čistenie extraktov, ale aj možnosť stanovenia malých množstiev ochratoxínu - tzv. limit detekcie je 0,1 μg / cm3.
Na stanovenie mykotoxínu ochratoxínu A vo víne a vínnych materiáloch prejde 10 cm3 vzorky cez koncentračnú patrónu Diapak C16MT, pričom sa vzorka 10-krát skoncentruje a nakoniec sa prečistí 1 cm3 acetonitrilu. Výsledný extrakt v množstve 5 μl a štandard sa nanesú na TLC platne a chromatografická separácia (elúcia) sa uskutoční v pripravenej chromatografickej komore s príslušnými eluentmi. Ako najoptimálnejší na separáciu mykotoxínu sa ukázal systém rozpúšťadiel vo forme izopropanolu a amoniaku. Je dosť nestály a má nízky retenčný koeficient.
Rf na sorbente. Mykotoxínové škvrny boli vyvinuté ožiarením ultrafialovým svetlom s dlhou vlnovou dĺžkou (365 nm). Pri vystavení UV žiareniu mykotoxínové škvrny žiaria modrozeleno.
Identifikácia a kvantitatívne stanovenie ochratoxínu sa uskutočnilo skenovacou denzometriou na denzitometri Sorbfil so špecializovaným programom na spracovanie výsledkov analýzy a výpočet parametrov chromatogramu.
Použitie denzitometra robí metódu TLC kvantitatívnou, porovnateľnou v rozlíšení s HPLC, pričom si zachováva všetky výhody TLC.
Navrhovaná metóda bola testovaná na vzorkách vína s predbežným zavedením určitých množstiev ochratoxínu. Metóda umožňuje rýchlo a presne kontrolovať obsah ochratoxínu vo vínnych produktoch.
LITERATÚRA
1. Kretová L. Glunev L. I. Mykotoxíny. Kontaminácia produktov a analytická kontrola. - M.: Agrprogress, 2000.
2. Rokovanie zhromaždenia OIM. - Paríž, 2000. - S. 57-59.
3. Sprievodca modernou tenkovrstvovou chromatografiou / Ed. O.G. Larionova // Na základe materiálov školského seminára o chromatografii na tenkej vrstve. - M., 1994.
Laboratórium technológie výroby vína
Prijaté 08.09.04
N.T. SIYUKHOVA
Štátna technologická univerzita Maykop
V súčasnosti sa venuje vážna pozornosť problematike kontaminácie poľnohospodárskych plodín toxickými látkami rôzneho charakteru vrátane pesticídov. Medzi plodinami najviac ošetrovanými chemickými prostriedkami na ochranu pred škodcami a chorobami vyniká vinič hroznorodý. Kvôli opakovaným ochranným ošetreniam v každom vegetačnom období sú vinohrady dlho považované za akýsi akumulátor ekologicky nebezpečných chemikálií.
Patria sem organofosforové zlúčeniny, ktoré sa vyznačujú zvýšeným rizikom akumulácie v ošetrovaných oblastiach a vedú z hľadiska praktickej aplikácie. Tieto lieky sa hromadia v rastlinných bunkách. Najnebezpečnejšie a najintenzívnejšie sú nimi kontaminované bobule, čo v konečnom dôsledku ovplyvňuje kvalitu a ekologickú nezávadnosť produktov vyrobených z hrozna. Vzhľadom na vysokú toxicitu a stabilitu organofosforových zlúčenín a ich metabolitov má stanovenie kontaminácie hroznových produktov nimi veľký vedecký a praktický význam.
Na výrobných miestach špecializovanej farmy AF "Fanagoria" (okres Temryuk) bola vykonaná (1999-2002) toxikologická kontrola odrôd červeného hrozna. Počas zberu boli odobraté vzorky a v akreditovanom skúšobnom toxikologickom laboratóriu SKZNIISiV bola vykonaná analýza produktov na obsah zvyškových množstiev organochlórových a fosforových insekticídov. Princíp výberu hroznových pozemkov na odber vzoriek bol založený na tom, že úroda hrozna z nich bola použitá na továrenské spracovanie a prípravu suchých červených vín v mikro vinotéke laboratória na spracovanie hrozna SKZNIISiV.
Pri plánovaní experimentov na štúdium zadržiavania toxických látok v hrozne sa bral do úvahy možný vplyv dvoch faktorov, ktoré spolu určujú prejav potenciálneho nebezpečenstva vstupu insekticídov do pestovaného hrozna: prenikanie toxických zvyškov z pôdy plantáží a zo samotnej rastliny v dôsledku súčasného sezónneho ošetrenia
Koncentrácia ochratoxínu A vo vzorke, mg/kg
Limity relatívnych chýb (index presnosti) (±d), %, R = 0,95
Štandardná odchýlka opakovateľnosti (s r), %
Limit opakovateľnosti ( r), %
Úplnosť extrakcie látok, %
4.2. Pomocné vybavenie
|
Zariadenie na pretrepávanie vzoriek typu АВУ-6С alebo podobné |
|
|
Rotačný odparovač IR-1M s odlučovačom alebo podobným |
|
|
Laboratórna sušiareň s chybou udržiavania teploty ±2,5 v rozsahu od 50 do 350 °C |
|
|
Chladnička pre domácnosť |
|
|
Elektrický laboratórny mlyn EM-3A alebo podobný pH meter |
TU 46-22-236-79 |
|
Magnetické miešadlo typu MM 5 s miešadlom |
TU 25-11.834-80 |
|
Kužeľové banky s plochým dnom 250 cm3 s NSh 29, typ KnKSh 250-29/32 |
GOST 10394-74 |
|
Tmavé sklenené skrutkovacie fľaše (nečisté), 7 cm3 |
|
|
Odmerné banky, objem 100, 500, 1000 cm3 typ 2-100-2,2-500-2 |
|
|
Laboratórium lievikov |
|
|
Banky hruškovitého tvaru, 10 cm3, s NSh 14,5, typ GrKSh-10-14/23 |
GOST 10394-72 |
4.3. Činidlá a materiály
. Príprava na meranie
5.1. Príprava štandardných roztokov ochratoxínu A
Na prípravu štandardného skladovacieho roztoku (koncentrácia ochratoxínu A je 10 ng/µl) sa 5 mg vzorka kryštalického ochratoxínu A umiestni do odmernej banky s objemom 500 cm3, 50 cm3 zmesi toluén-kyselina octová Pridá sa (98:2 % obj.), dôkladne sa premieša až do úplného rozpustenia látky a privedie sa rovnaká zmes rozpúšťadiel po značku. Na stanovenie presnej koncentrácie zásobného roztoku sa meria jeho optická hustota pri vlnovej dĺžke 333 nm (D333). Koncentrácia roztoku sa vypočíta podľa vzorca:
Na prípravu pracovných roztokov ochratoxínu A s koncentráciou 0,005; Odoberie sa 0,05 a 0,1 ng/ul, 50, 500 a 1000 ul roztoku s koncentráciou 0,5 ng/ul, odparí sa do sucha a rozpustí sa v 5 cm3 mobilnej fázy.
Skladovací roztok ochratoxínu A sa uchováva v sklenenej nádobe so zabrúsenou zátkou na tmavom chladnom mieste (pri teplote asi 0 °C) do jedného roka a používa sa na prípravu pracovných štandardných roztokov. Pracovné štandardné roztoky sa uchovávajú vo fľaštičkách z tmavého skla na tmavom a chladnom mieste (pri teplote asi 0 °C) počas 1 mesiaca.
Pred použitím pracovných štandardných roztokov ich treba zohriať na izbovú teplotu a až potom otvoriť zátky.
5.2. Príprava roztoku fosfátového pufra, pH = 7,4
Odváženie 1,15 g disubstituovaného 12-vodného fosforečnanu sodného s hmotnosťou 1,15 g, odváženie monosubstituovaného 2-vodného sodíka s hmotnosťou 0,124 g a odváženie chloridu sodného s hmotnosťou 1,74 g sa prenesie do odmernej banky s objemom 100 cm3 sa pridá 10 - 20 cm3 destilovanej vody. Miešajte a doplňte objem roztoku v banke po značku. Čas použiteľnosti - 1 mesiac v chladničke.
5.3. Príprava zmesí rozpúšťadiel
toluén-octová kyselina (98:2 % o.).
Do odmernej banky s objemom 1000 cm3 pridajte 20 cm3 kyseliny octovej a za stáleho miešania doplňte po značku toluénom. Čas použiteľnosti - 1 mesiac na tmavom chladnom mieste.
acetonitril-voda (60:40 % o.).
Do odmernej banky s objemom 1000 cm3 pridajte 600 cm3 acetonitrilu a za stáleho miešania doplňte po značku vodou. Čas použiteľnosti - 1 mesiac na tmavom chladnom mieste.
acetonitril-voda (60:40 % o.; pH = 3 ,0 ).
Pridajte 600 cm3 acetonitrilu do 1000 cm3 odmernej banky a za stáleho miešania doplňte po značku dvakrát destilovanou vodou. Pridaním kyseliny fosforečnej sa pH zmesi upraví na hodnotu rovnajúcu sa 3,0. Čas použiteľnosti - 1 mesiac na tmavom chladnom mieste.
metanol-octová kyselina (98:2 % o.).
Do odmernej banky s objemom 1000 cm3 pridajte 20 cm3 kyseliny octovej a za stáleho miešania doplňte po značku metanolom. Čas použiteľnosti - 1 mesiac na tmavom chladnom mieste.
. Odber vzoriek a príprava vzoriek na analýzu
6.1. Výber vzorky
Aby sa zohľadnili špecifiká odberu vzoriek určitých typov výrobkov, mali by ste sa riadiť súčasnou regulačnou a technickou dokumentáciou:
„Kukurica. Pravidlá prijímania a metódy odberu vzoriek“ GOST 13586.3-83;
„Krúpa. Pravidlá prijímania a metódy odberu vzoriek“ GOST 26312.1-84;
„Múka a otruby. Metódy prijímania a odberu vzoriek“ GOST 27668-88;
„Potravinové výrobky v konzervách. Odber vzoriek a ich príprava na testovanie” GOST 8756.0-70.
Vzorky na analýzu, reprezentujúce koncentráciu mykotoxínov pre celú dávku, by sa mali odobrať z vopred homogenizovanej priemernej (počiatočnej) vzorky s hmotnosťou 2 kg.
6.2. Príprava vzorky na analýzu
Vybrané vzorky sa drvia 1 - 2 minúty v laboratórnom mlyne. V tomto prípade sa použijú dve paralelné vzorky.
6.2.1. Extrakcia
Časť 25 g rozdrvenej vzorky sa vloží do 250 cm kužeľovej banky s plochým dnom, pridá sa 100 cm3 zmesi acetonitril-voda (60:40 % obj.). Extrahujte na šejkri 30 minút. Výsledná zmes sa prefiltruje cez skladaný papierový filter s modrou páskou. Odoberte 10 ml filtrátu a pridajte 90 ml fosfátového tlmivého roztoku, pH = 7,4.
6.2.2. Čistenie extraktu
100 ml výslednej zmesi sa nanesie na imunoafinitnú kolónu rýchlosťou 1-2 kvapky za sekundu, premyje sa 20 cm3 roztoku fosfátového pufra, pH = 7,4. Ochratoxín A sa eluuje 3 cm3 metanolu a kyseliny octovej (98:2 % objemových).
. Vykonávanie meraní
7.1. Príprava skúšobnej vzorky
Eluát sa odparí do sucha. Suchý zvyšok sa rozpustí v 400 μl mobilnej fázy (roztok A).
7.2. Chromatografické podmienky
Podmienky HPLC: mobilná fáza - acetonitril-voda (60:40 % obj.; pH = 3,0); rýchlosť mobilnej fázy - 1,5 cm3/min.
Fluorimetrický detektor je nastavený na vlnovú dĺžku budiaceho žiarenia 333 nm, na emisnej linke je inštalovaný emisný filter so šírkou pásma 466 nm.
Na analýzu vzorky sa 50 μl testovanej vzorky (roztok A) vstrekne do injektora chromatografu pomocou mikrostriekačky. V prítomnosti píku, ktorý sa zhoduje s retenčným časom s ochratoxínom A, vypočítajte hmotnosť ochratoxínu A v teste pomocou kalibračnej krivky.
. Spracovanie výsledkov merania
8.1. Konštrukcia odstupňovanej závislosti
Na vytvorenie kalibračného grafu sa vykoná chromatografická analýza série pracovných roztokov štandardov. Pomocou mikrostriekačky sa do injektora vstrekne 50 µl štandardného pracovného roztoku s koncentráciou 0,005 ng/µl, čo zodpovedá 0,25 ng ochratoxínu A. To isté sa robí pre ostatné štandardné roztoky s koncentráciou 0,05 a 0,10 ng/ ul, čo zase zodpovedá 2,5 a 5,0 ng ochratoxínu A na injekciu. Za týchto podmienok je retenčný čas ochratoxínu A v rozmedzí 4 až 5 minút. Na základe získaných údajov sa zostaví kalibračný graf (závislosť plochy chromatografického píku od hmotnosti ochratoxínu A v nástreku).
Výsledok analýzy je prezentovaný vo forme (s pravdepodobnosťou R = 0,95):
![]()
D - limit absolútnej chyby:
![]()
d je hranica relatívnej chyby techniky (index presnosti), % (tabuľka 1).
* 0,0001 mg/kg - limit detekcie.
. Kvalifikačné požiadavky na výkon
Analýzu ochratoxínu A v obilí a obilných produktoch môžu vykonávať osoby so špeciálnym vysokoškolským vzdelaním alebo so stredným odborným vzdelaním, ktoré vlastnia techniku HPLC analýzy, majú príslušné vzdelanie a prax v chemickom laboratóriu.
. Podmienky merania
Teplota okolia od 15 do 25 °С.
Relatívna vlhkosť vzduchu nie viac ako 80% pri 25 °С.
Atmosférický tlak 730 - 760 mm Hg.
Napájacie napätie: 210 - 220 V. Frekvencia striedavého prúdu: 45 - 50 Hz.
Leták
Súpravy a sú testovacie systémy pre enzýmovú imunoanalýzu. Sú komerčne dostupné v súlade s ISO 9000 spolu s potrebnými činidlami a sú určené na kvantitatívne stanovenie ochratoxínu v obilninách, krmivách, obilných produktoch, pive a krvnom sére. Pokyny na používanie testovacích systémov RIDASCREEN® FAST ochratoxín A A RIDASCREEN® ochratoxín A schválené odborom veterinárnej medicíny Federálnej agentúry pre poľnohospodárstvo Ministerstva poľnohospodárstva Ruska pod číslom MUK 5-1-14/1001. Systémy sú zaradené do „Zoznamu normatívnej dokumentácie povolenej na použitie v štátnych veterinárnych laboratóriách pri diagnostike chorôb zvierat, rýb, včiel, ako aj pri monitorovaní bezpečnosti surovín živočíšneho a rastlinného pôvodu“. Testovacie systémy RIDASCREEN® FAST ochratoxín A korešpondovať GOST 34108-2017"Krmivo, zmiešané krmivo, zmiešané kŕmne suroviny. Stanovenie obsahu mykotoxínov priamym kompetitívnym enzýmovým imunotestom na pevnej fáze".
Stanovenie ochratoxínu A v obilí, krmivách, obilných výrobkoch, pive a krvnom sére
Ocratoxín je jedovatá látka, ktorá vzniká v dôsledku životne dôležitej aktivity plesňových húb rodu Aspergillus A Penicillium. Spolu s výraznou nefrotoxicitou má ochratoxín hepatotoxické, teratogénne, karcinogénne a imunosupresívne vlastnosti. S produktmi rastlinného a živočíšneho pôvodu sa ochratoxín môže dostať do ľudského tela. Nachádza sa nielen v obilninách (13 % pozitívnych vzoriek) a krmivách pre zvieratá, ale aj v krvi ošípaných (60 % pozitívnych vzoriek) a obličkách (21 % pozitívnych vzoriek).
Technické predpisy colnej únie TR CU 021/2011 „O bezpečnosti potravín“ regulovať nasledujúcu maximálnu hladinu obsahu ochratoxínu A: v obilninách, obilninách, múke - 0,005 mg / kg (5 μg / kg); v detskej výžive, potravinách pre predškolákov a školákov, potravinách pre tehotné a dojčiace ženy – nepovolené (<0,0005 мг/кг).
Návrh federálneho zákona № 349084-5 „Technické predpisy pre vinárske produkty“ stanovujú požiadavky na obsah ochratoxínu A vo víne najviac 0,002 mg/l.
Návrh federálneho zákona „o požiadavkách na bezpečnosť potravinárskych výrobkov a procesoch ich výroby, skladovania, prepravy, predaja a likvidácie“ obsahuje aj požiadavku na povinnú kontrolu potravinárskych obilnín na ochratoxín A, ktorých obsah by nemal presiahnuť 0,005 mg /kg. Aktuálnu právnu úpravu nájdete na webovej stránke compact24.com.
Až donedávna sa na kontrolu ochratoxínu používali prevažne chromatografické metódy (vysokoúčinná kvapalinová chromatografia, chromatografia na tenkej vrstve). Oveľa vhodnejšia metóda enzýmovej imunoanalýzy (ELISA alebo ELISA), ktorá má veľmi vysokú citlivosť.
| špecifikácia: | RIDASCREEN® FAST ochratoxín A | RIDASCREEN® ochratoxín A 30/15 |
| formát: | Strip platnička, 48 jamiek (6 stripov po 8 jamiek) | Strip platnička, 96 jamiek (12 stripov po 8 jamiek) |
| Normy: | 0/5/10/20/40 ug/l | 0/50/100/300/900/1800 ng/l |
| Príprava vzorky: | Mletie vzorky, extrakcia, filtrácia | extrakcia, odstreďovanie/filtrovanie (obilia, krmiva); extrakcia, odstreďovanie, filtrácia, trepanie, nadmerná extrakcia, odstreďovanie, odparovanie (pivo/sérum) |
| Strávený čas: | ||
| Limit detekcie: | 0,005 mg/kg | 0,001250 mg/kg (obilie, krmivo) 0,000050 mg/kg (pivo, krvné sérum) |
Súvisiace produkty:
Ochratoxíny produkujú určité druhy húb. Aspergillus A Penicillium. Hlavnými výrobcami sú A.ochraceus A P. viridicatum. Tieto huby sa nachádzajú všade. Aspergillus pri zvýšenej teplote a vlhkosti produkuje ochratoxíny a Penicillium už pri 5°C. Ochratoxíny sú vysoko toxické zlúčeniny s výrazným teratogénnym účinkom.
Ochratoxíny A, B a C sú skupinou štruktúrne príbuzných zlúčenín, s ktorými sú spojené izokumaríny L-fenylalanínová peptidová väzba. V závislosti od charakteru radikálov vznikajú rôzne druhy ochratoxínov (tab. 2.3.).
Ochratoxín A je bezfarebná kryštalická látka, málo rozpustná vo vode, stredne rozpustná v polárnych organických rozpúšťadlách (metanol, chloroform), ako aj vo vodnom roztoku uhličitanu sodného. V chemicky čistej forme je nestabilný a veľmi citlivý na svetlo a vzduch, ale v etanolovom roztoku môže zostať dlho nezmenený. V UV svetle má zelenú fluorescenciu.
Ochratoxín B je kryštalická látka, analóg ochratoxínu A, ktorá neobsahuje atóm chlóru. Je asi 50-krát menej toxický ako ochratoxín A. V UV svetle má modrú fluorescenciu.
Ocratoxín C je amorfná látka, etylester ochratoxínu A, ktorý sa mu približuje toxicitou, ale nebol nájdený ako prirodzený kontaminant potravín a krmív. Vo svetle Y má svetlozelenú fluorescenciu.
Ochratoxíny patria medzi toxické mykotoxíny, majú vysokú toxicitu pre pečeň, obličky, teratogénne a imunosupresívne vlastnosti a výrazný hemolytický účinok. Z ochratoxínov je najtoxickejší ochratoxín A (LD 50 = 3,4 mg/kg, (jednodňové kurčatá, orálne)). Je toxickejší ako aflatoxíny. Ostatné mykotoxíny tejto skupiny sú rádovo menej toxické.
Biochemické, molekulárne a bunkové mechanizmy pôsobenia ochratoxínov nie sú dobre známe. Je známe, že ochratoxín A inhibuje syntézu proteínov a metabolizmus uhľohydrátov, najmä glykogenózu, inhibíciou aktivity fenylalanínu, tRNA, špecifického enzýmu, ktorý hrá kľúčovú úlohu v počiatočnom štádiu syntézy proteínov.
Ochratoxín A sa nachádza v kukurici, jačmeni, pšenici, ovse a jačmeni. Dôležité a nebezpečné je, že ochratoxín A sa nachádza v živočíšnych produktoch (šunka, slanina, klobásy) pri vysokej kontaminácii kŕmnych obilnín a krmiva pre zvieratá. Ochratoxín B je zriedkavý. Ocratoxíny ovplyvňujú aj všetky plody záhradných plodín. Postihnuté sú najmä jablká: až 50 % úrody môže byť kontaminovaných mykotoxínmi.
Treba poznamenať, že ochratoxíny sú stabilné zlúčeniny. Napríklad pri dlhodobom zahrievaní pšenice kontaminovanej ochratoxínom A sa jej obsah znížil iba o 32% (pri teplote 250–300ºС). Prevalencia ochratoxínov v potravinách, toxicita a perzistencia ochratoxínov teda predstavujú skutočné nebezpečenstvo pre ľudské zdravie.
Analytické metódy
Ochratoxín A sa nachádza v oxidovaných potravinách. Ľahko sa rozpúšťa v mnohých organických rozpúšťadlách, čo sa používa na extrakciu. Najčastejšie sa používa extrakcia chloroformom a vodným roztokom kyseliny fosforečnej, po ktorej nasleduje čistenie na kolóne a kvantitatívne stanovenie metódou TLC.
Bola vyvinutá aj metóda HPLC. Pred analýzou HPLC sa vzorka pripraví nasledovne. Rozdrvená vzorka sa ošetrí zmesou 2 M kyseliny chlorovodíkovej a 0,4 M roztokom chloridu horečnatého. Po homogenizácii sa extrahuje toluénom počas 60 minút. Zmes sa odstredí. Centrifúga sa nechá prejsť cez kolónu silikagélu a premyje sa zmesou toluénu a acetónu (mobilná fáza). Ochratoxín A sa eluuje zmesou toluénu a kyseliny octovej (9:1) a suší sa pri 40 °C. Zvyšok sa rozpustí a prefiltruje. Analýza sa uskutočňuje pomocou HPLC.
Okrem toho bolo vyvinutých množstvo biologických testov na krevetách a baktériách, ale získané výsledky neumožnili použiť tieto metódy na stanovenie ochratoxínov.